Le intelligenze artificiali sono parte della nostra vita. L’interazione tra medicina e IA (Intelligenza Artificiale) ha come effetto l’aumento delle capacità diagnostiche e terapeutiche. Il software di intelligenza artificiale Google DeepMind sta dando meravigliosi risultati in questo campo. È basato sull’apprendimento profondo – deep learning – un insieme di tecniche basate su reti neurali artificiali organizzate in diversi strati. Si tratta dell’eredità di un genere di software introdotto negli anni ’80 del secolo scorso: le reti neurali artificiali. Consistono in sistemi di semplici elementi interconnessi, ispirati ai neuroni biologici, con la proprietà di non dover essere programmati come i normali software, ma di apprendere qualunque genere di funzione da opportune esperienze.
L’algoritmo di DeepMind, ancora oggi in fase di studio, nasce per diagnosticare il cancro al seno, il carcinoma polmonare, alcune patologie dell’occhio e per la previsione della struttura proteica di alcuni batteri.
Le reti neurali
Il deep learning, su cui è basato il sistema, utilizza reti neurali artificiali – dette ANN o NN – fondate sulla simulazione di neuroni artificiali collegati. Una rete neurale è un modello matematico sfruttato per risolvere problemi non facilmente codificabili, composto da diversi strati di unità neuronali, le quali trasferiscono segnali tra di loro attraverso connessioni pesate. Questi pesi sono valori numerici che vengono moltiplicati ai valori degli stessi neuroni. Ciascun neurone somma i valori pesati di tutti i neuroni ad esso collegati, aggiungendo un valore di bias a cui viene applicata una trasformazione matematica che ne modifica il risultato. Una struttura di questo tipo è in grado di individuare nessi logici tra input, nuove associazioni tra dati oppure comprendere quali dati allontanano dal risultato atteso. Tutto questo grazie ad un opportuno addestramento, il quale determina un bilanciamento dinamico dei pesi, in funzione del raggiungimento dei risultati desiderati.
DeepMind possiede capacità di diagnostica grazie al lungo ed approfondito addestramento eseguito utilizzando migliaia di dati clinici reali. La complessità insita delle reti neurali rende però estremamente difficile spiegare come si arriva a determinati risultati, poiché è umanamente impossibile predire e replicare il flusso di operazioni eseguite autonomamente per bilanciare i pesi delle connessioni tra i neuroni. È grazie a questa caratteristica che le intelligenze artificiali riescono a prendere decisioni in una maniera simile a quella umana.
Rilevazione del tumore al seno
DeepMind, come già accennato, riesce a rilevare in modo accurato il tumore al seno negli stadi iniziali, riducendo i casi di falsi negativi e falsi positivi. Secondo il World Cancer Report 2014, il cancro al seno è il tumore più diffuso a livello globale nel genere femminile e sembra essere in costante aumento. Secondo l’Agenzia internazionale per la ricerca sul cancro (IARC), le mammografie, previste a partire dai 50 anni di età, hanno permesso di ridurre il tasso di mortalità per tumore al seno del 40%. Il problema è che l’accuratezza delle immagini ottenute non raggiunge mai il 100%, rendendo frequenti i falsi positivi e i falsi negativi.
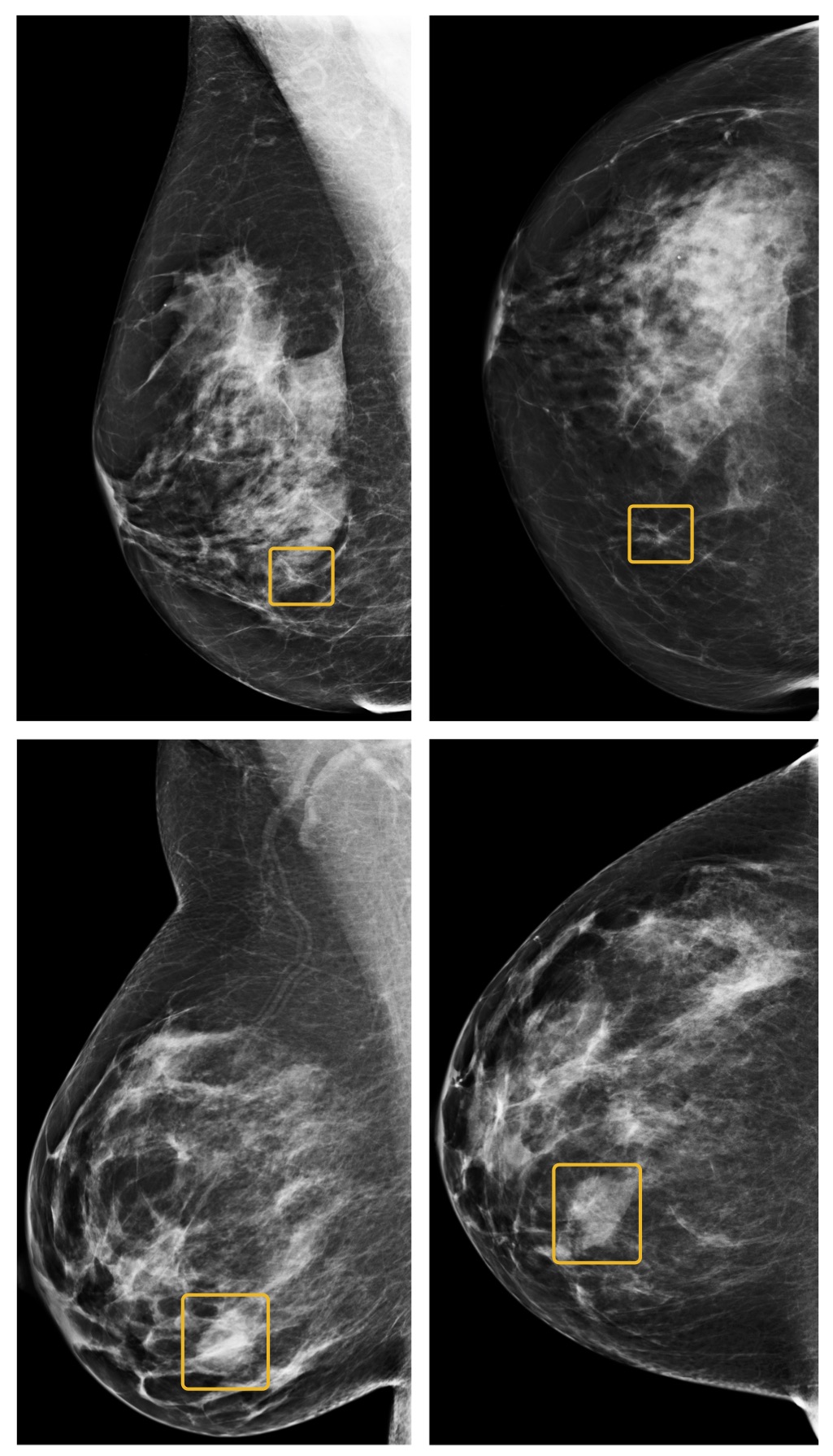
Gli algoritmi sono stati istruiti utilizzando migliaia di immagini mammografiche di diagnosi già concluse.
Lo studio condotto da Nature segnala come DeepMind non sia infallibile, ma che in determinate condizioni si riveli addirittura più efficiente della sua controparte umana. Il futuro è la collaborazione tra specialisti e intelligenze artificiali, non la sostituzione umana. Un futuro in cui gli individui sono affiancati nella risoluzione dei problemi dalle intelligenze artificiali: strumenti che migliorano la qualità delle diagnosi.
Rilevazione di patologie della retina
Il Moorfields Eye Hospital di Londra nel 2016 è entrato a far parte del progetto DeepMind, diventato ora Google Health. La collaborazione nacque per investigare come l’intelligenza artificiale potesse incontrare le necessità mediche della clinica. Essa registra infatti circa 5000 esami di Tomografia Ottica Computerizzata alla settimana, dove per ogni scansione è richiesto molto tempo per l’analisi. La rapidità di questa fase impatta direttamente la velocità nel diagnosticare eventuali patologie.
In due anni, la collaborazione ha portato a dimostrare come la tecnologia sviluppata è stata in grado di eguagliare l’accuratezza degli esperti nell’identificazione delle patologie oculari. Ma il risultato decisivo è stato l’analisi delle scansioni tomografiche. Addestrata l’IA con immagini e diagnosi di precedenti esami, essa è stata in grado di interpretare in maniera precisa le immagini, restituendo un risultato in tempi brevi.
DeepMind è in grado di interpretare il risultato delle scansioni oculari, indirizzando i pazienti al trattamento più idoneo. Inoltre, le decisioni prese vengono supportate da informazioni cliniche aggiuntive, le quali vengono fornite ai medici per essere validate.
Attualmente il progetto prosegue: l’IA viene continuamente allenata sui nuovi dati forniti dai pazienti consenzienti e, parallelamente, i ricercatori e i medici effettuano tutti i controlli sull’accuratezza dei risultati, in modo da poter – in futuro – estendere l’adozione anche ad altre cliniche.
Previsione della struttura proteica
Con il sistema AlphaFold, DeepMind ha potuto determinare la struttura tridimensionale di una proteina partendo dalla sua sequenza di amminoacidi. Senza l’ausilio dell’intelligenza artificiale, il processo di previsione della struttura proteica richiede l’utilizzo di metodi sperimentali, come la cristallografia a raggi X o la microscopia crioelettronica e tempi lunghissimi: si tratta infatti non di non mesi, ma bensì di anni. Il sistema di intelligenza artificiale ha invece realizzato la previsione in 30 minuti e con un’accuratezza del 92%.
Perché la previsione della struttura proteica è così importante? Perché la forma assunta da ogni proteina ne determina le funzioni che andrà a svolgere. Di conseguenza riuscire a comprenderla porta ad una maggiore comprensione sull’utilizzo che se ne deriva come, ad esempio, sviluppare trattamenti per alcune malattie.
DeepMind e l’utilizzo dei dati
Per poter funzionare, l’intelligenza artificiale – indipendentemente dal tipo di attività che dovrà svolgere – deve avere a disposizione il maggior numero di dati possibili. Maggiore è la quantità di informazioni da usare per l’addestramento, migliore sarà la correttezza dei risultati.
In campo medico, questa necessità si traduce con l’utilizzo dei dati di pazienti reali. Immaginandoci ricoverati in ospedale, come reagiremmo alla richiesta del nostro medico di firmare l’autorizzazione a rilasciare i nostri dati per allenare un IA?
Sicuramente si tratta di una richiesta che potrebbe lasciare dubbiosi, ma lecita nell’idea di contribuire a sviluppare un sistema in grado di affiancare e migliorare le cure mediche.
Si tratta di un’aspetto importante di cui tenere conto, in quanto l’utilizzo di informazioni cliniche può esporre a pericoli di divulgazione inconsapevole. In questo senso è necessaria l’adozione di standard di sicurezza ed anonimizzazione dei dati, evitando di poter risalire all’identità di un paziente senza la sua autorizzazione.
DeepMind nei prossimi anni potrebbe rendere di dominio pubblico e quotidiano i suoi utili strumenti nei vari ambiti della medicina. L’età media umana si alza di anno in anno, con grande fatica di tutto il personale sanitario e dei ricercatori. Fornire loro uno strumento in grado di aumentare la precisione nell’interpretazione delle cartelle cliniche non potrà far altro che giovare a tutti. Eliminando, magari, quegli ostacoli che l’uomo, da solo, non riesce a superare.
ITManager.space (2020). Reti Neurali, cosa sono e perché si usano nell’analisi dei dati
DeepMind. About
Senior A., Jumper J., Hassabis D., & Kohli P. (2018). AlphaFold: Using AI for scientific discovery. DeepMind
Li J., Han X., Zhang X., & Wang S. (2019). Spatiotemporal evolution of global population ageing from 1960 to 2017. BMC public health, 19(1), 1-15.